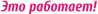Шестакова Лиана Геннадьевна
врач-кардиохирург высшей квалификационной категории, доктор медицинских наук,
Республиканский научно-практический центр «Кардиология», Минск, Беларусь.
Введение
В настоящее время кардиохирургические вмешательства в условиях искусственного кровообращения остаются наиболее эффективным методом лечения приобретенных и врожденных пороков сердца, ишемической болезни сердца и аневризм грудной аорты. Для выполнения основного этапа операции полностью пережимается восходящая аорта с целью визуализации операционного поля и предотвращения воздушной эмболии магистральных сосудов, затем проводятся кардиоплегии для защиты миокарда. Период глобальной ишемии миокарда достигает нескольких часов и, при недостаточной эффективности кардиоплегий, сопровождается выраженными метаболическими нарушениями в миокарде [1].
Оксигенированный гемоглобин в зоне ишемии стремительно истощается. Основной путь, используемый для выработки энергии в миокарде, меняется с аэробного окисления на анаэробный гликолиз [2,3]. Первичный субстрат энергетического метаболизма миокарда также меняется со свободных жирных кислот на глюкозу [4]. Ишемизированный миокард преимущественно использует энергию, содержащуюся в эндогенном креатинфосфате, за которым следуют АТФ, АДФ и аденозинмонофосфат (AMФ). АМФ также может расщепляться на аденозин и гипоксантин, что приводит к необратимым изменениям [5]. Кроме того, молочная кислота и другие промежуточные продукты гликолиза накапливаются в кардиомиоцитах [2,3]. Через 10 мин ишемии внутриклеточный рН снижается до 5,7–6,0, при таком ацидозе существенно снижается скорость рефосфорилирования АДФ в АТФ путем анаэробного гликолиза [6]. В свою очередь, повышенный из-за накопления уровень АДФ может индуцировать адгезию и агрегацию тромбоцитов [7].
Потеря ВЭФ влияет на клеточный гомеостаз кальция, приводя к внутриклеточной секвестрации Ca2+. Перегрузка митохондрий кальцием угнетает окислительное фосфорилирование. Внутриклеточный Ca2+ индуцирует превращение ксантиндегидрогеназы в ксантиноксидазу. Последняя способствует образованию свободных радикалов кислорода, которые, в свою очередь, окисляют мембранные фосфолипиды и продуцируют малоновый диальдегид (MDA), вызывая нестабильность мембраны [8,9].
Кроме того, внутриклеточное накопление метаболических промежуточных продуктов, включая АМФ, молочную кислоту, Са2+, Н+ и т.д., активирует мембранную фосфолипазу, вызывая деградацию клеточной мембраны до лизофосфоглицеридов (LPLs), которые также способствуют нестабильности мембран клеток миокарда [9,10].
После выполнения основного этапа операции снимается поперечный зажим с восходящей аорты и возобновляется коронарный кровоток. В этот момент к предшествующей ишемической альтерации присоединяются дополнительные реоксигенационные повреждения миокарда. В механизме реперфузионных повреждений центральное место занимает массивное поступление кальция в кардиомиоциты, контрактура миофибрилл, активация мембранных фосфолипаз с нарушением целостности клеточных мембран, образование свободных радикалов, электрофизиологические изменения [11].
Очевидна необходимость специальных мер сохранения жизнеспособности миокарда (кардиопротекции) при операциях на открытом сердце: холодовых кардиоплегий, контролируемой реперфузии миокарда, применения фармакологических кардиопротекторов.
Со времени первой публикации Parrat и Marshall [12] было доказано, что введение экзогенного фосфокреатина в коронарное русло эффективно защищает ишемизированный миокард благодаря следующим механизмам.
Во-первых, регуляция энергетического обмена в кардиомиоцитах [8,13]:
а) ФК является запасной быстродоступной формой биохимической энергии, непосредственно используется для ресинтеза АТФ
б) ФК является накопителем и транспортным носителем энергии, который служит для переноса ВЭФ-связи от места образования АТФ к месту утилизации АТФ посредством «фосфокреатинового шатла».
в) ФК, достигнув определенной концентрации (10 ммоль/л), оказывает ингибирующее влияние на ферментные системы (5'-нуклеотидазу и AMP-дезаминазу), обеспечивающие катаболизм адениннуклеотидов, тем самым поддерживая уровень пула нуклеотидов, выступая в качестве регулятора
Во-вторых, стабилизация клеточных мембран [8]:
а) благодаря электростатическому взаимодействию ФК с фосфолипидами, уменьшается их разрушение и накопление в ишемизированном миокарде,
б) ФК ингибирует лизофосфоглицериды – основной фактор электрической нестабильности мембран, что в условиях гипоксии защищает сарколемму кардиомиоцитов от ишемического повреждения,
В-третьих, предотвращение агрегации тромбоцитов путем рефосфорилирования АДФ в АТФ (внеклеточный механизм).
В-четвертых, улучшение микроциркуляции, связанное с повышением осмотической резистентности эритроцитов и улучшением пластичности их мембран за счет увеличения содержания АТФ. Кроме того, увеличение содержания АТФ в эритроцитах ведет к повышению кислородной емкости крови [13, 14].
Таким образом, лечение экзогенным фосфокреатином способствует защите миокарда от ишемически-реперфузионной альтерации. Результаты большого количества клинических исследований подтверждают, что применение экзогенного ФК ассоциировано с улучшением краткосрочной выживаемости, улучшением систолической и диастолической функции сердца, меньшим высвобождением маркеров повреждения миокарда, снижением частоты жизненноопасных аритмий [15,16].
В Республике Беларусь разработан и успешно применяется комплексный метод кровяной защиты миокарда (патент BY 6174, а19990439 «Способ кардиопротекции при хирургических операциях в условиях искусственного кровообращения», Шестакова Л.Г., Островский Ю.П.). Бесспорные успехи современной кардиохирургии, усовершенствование методов защиты миокарда, экстракорпорального кровообращения и механической поддержки кровообращения привели к расширению показаний к хирургическому лечению, в частности, у пациентов с исходно сниженными функциональными возможностями миокарда. Это, в свою очередь, диктует необходимость дополнительных мер кардиопротекции, включая метаболическую и мембраностабилизирующую терапию. Весьма важна оценка эффективности и безопасности интракоронарного введения кардиопротекторов.
Цель исследования
Провести сравнительную оценку клинической эффективности интракоронарного введения препаратов экзогенного фосфокреатина (креатинфосфат динатриевой соли) в составе контролируемой реперфузии после периода глобальной ишемии миокарда во время операций на открытом сердце в условиях искусственного кровообращения у пациентов со сниженной фракцией выброса левого желудочка.
Материалы и методы
Проведено сравнительное рандомизированное открытое контролируемое клиническое исследование в параллельных группах. Во время контролируемой реперфузии миокарда с целью его защиты во время операции на сердце в стационарных условиях согласно схеме терапии (с применением комплексного метода защиты миокарда на основе крови – патент а 19990439) в составе кардиоплегических растворов пациентам опытной группы вводился лекарственный препарат Креатинфосфат, порошок для приготовления раствора для инфузий 1,0 г, производства СП ООО «ФАРМЛЭНД» (Республика Беларусь), в концентрации 10 ммоль/л (по фосфокреатину). В группе сравнения применялось лекарственный препарат Неотон, лиофилизированный порошок для приготовления раствора для инфузий 1,0 г во флаконах производства ALFASIGMA S. p. a., Италия.
Клиническое исследование проводилось в РНПЦ «Кардиология» в 2021 – 2022 г.г. в соответствии с ICH-GCP, правилами надлежащей клинической практики ЕАЭС и Хельсинкской Декларации Всемирной Медицинской Ассоциации (Форталеза, 2013).
Критерии включения пациентов в исследование:
1) мужчины и женщины в возрасте 18-80 лет
2) необходимость проведения аортокоронарного шунтирования (АКШ), маммарокоронарного шунтирования (МКШ) и (или) клапанной коррекции в условиях ИК с применением комплексного метода защиты миокарда на основе крови
3) снижение ФВ левого желудочка менее 45% по данным эхокардиографии (ЭхоКГ)
4) оценка факторов риска кардиохирургических вмешательств по шкале EuroSCORE II 1-12 %
5) подписанное информированное согласие на участие в испытании
6) способность пациента выполнять все требования программы.
В исследование не включались пациенты с выполненными ранее кардиохирургическими вмешательствами в условиях ИК, с расслаивающей аневризмой грудной аорты, после трансплантации органов, с выраженными нарушениями функции почек, с онкологическими заболеваниями, с острыми инфекционными заболеваниями (в частности, инфекционный эндокардит).
В исследование вошли 158 человек (по 79 пациента в каждой группе). Врачами-исследователями проводилась простая рандомизация с применением метода конвертов.
Продолжительность клинического исследования для каждого пациента составила 7±1 дней, включала 5 точек наблюдения:
1. не более чем за 24 часа до операции,
2. во время операции и в первые 2 часа после операции,
3. через 10-24 ч после операции,
4. через 34-48 ч после операции,
5. через 7±1 суток после операции.
Всем пациентам выполнялись общеклинические исследования, оценка факторов риска кардиохирургических вмешательств по шкале EuroSCORE II; общие анализы крови и мочи, биохимические анализы крови; определение высокочувствительного тропонина I (hsTnI); оценка АД, ЦВД, ЧСС, температуры тела; ЭКГ; трансторакальная ЭхоКГ; оценка интраоперационного восстановления сердечной деятельности (количество дефибрилляций после снятия зажима с аорты); определение количества и доз введенных адреномиметиков (мкг, мкг/кг/мин); регистрация нежелательных явлений/реакций; оценка частоты развития посткардиотомной острой сердечной недостаточности.
Статистичекий анализ полученных данных выполнялся с применением программы IBM SPSS Statistics (версия 26). При сравнении двух групп по количественному признаку применяли параметрический метод с вычислением t-критерия Стъюдента для зависимых групп (в случае нормального распределения признака). Полученные данные интерпретировались как достоверные, а различия между показателями считались значимыми при вероятности безошибочного прогноза равного или большего 95%: р ≤ 0,05. Достоверность различий в сравниваемых несвязанных группах (оценка эффективности применяемых лекарственных средств), а также связанных (в каждой группе до и после лечения) осуществлялась с использованием критерия χ2 Пирсона или точного двустороннего F-критерия Фишера в зависимости от значений абсолютных частот. Достоверность различий распределения пациентов в сравниваемых связанных группах определялась при помощи критерия Макнемара.
Результаты и обсуждение
В исследование включено 86,7% мужчин (n=137) и 13,3% женщин (n=21) в возрасте от 31 года до 80 лет. Средний возраст составил 60,34 года (ст. отклонение 9,36 лет).
Индекс массы тела (ИМТ) пациентов варьировал от 18,59 до 44,92 кг/м2. Среднее значение ИМТ составило 28,94 кг/м2 (ст. отклонение 5 кг/м2). (рис 1).
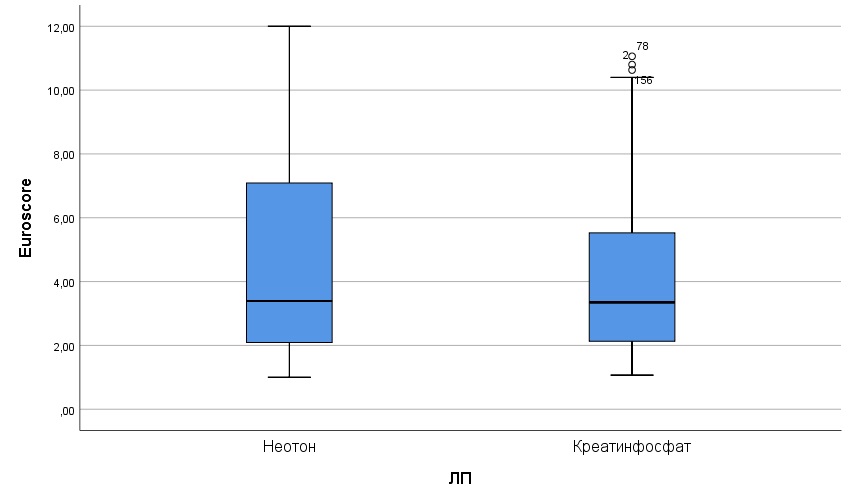
Рис.1. Показатели операционного риска по шкале EuroSCORE II в сравниваемых группах
Виды оперативного вмешательства: АКШ и МКШ (изолированно либо с клапанной коррекцией) выполнено у 65,8% исследуемых пациентов (n=104); вмешательство на клапанах сердца (пластика и /или протезирование) выполнено у 34,2% пациентов (n=54).
По соотношению полов, возрасту, ИМТ, значению EuroSCORE II и типу оперативного вмешательства обе группы были однородными и статистически значимые отличия между ними отсутствовали (р>0,05) (табл.1)
Таблица 1
Исходная клиническая характеристика пациентов по группам
|
Показатель |
Группа Креатинфосфат |
Группа Неотон |
|
Количество пациентов |
79 |
79 |
|
% мужчин в группе |
87 |
86 |
|
Средний возраст (± ст. откл.), лет |
60,01 (9,24) |
60,66 (9,53) |
|
Средний ИМТ (± ст. откл.), кг/м2 |
28,57 (5,03) |
29,30 (4,97) |
|
EuroSCORE II (± ст. откл.) % |
4,21 (2,71) |
4,65 (3,18) |
По видам оперативного вмешательства обе группы были однородными, статистически значимые отличия между ними отсутствовали: в каждой из групп реваскуляризация миокарда (АКШ, МКШ) была выполнена у 66% пациентов (р>0,05).
Оценка эффективности кардиопротекции в группах
После завершения основного этапа операции проводилась контролируемая реперфузия и снимался зажим с аорты. У 80% пациентов из группы Креатинфосфат и 81% пациентов из группы Неотон наблюдалось самостоятельное восстановление сердечной деятельности после реперфузии (р=0,842), что свидетельствовало о функциональной сохранности миокарда и высокой эффективности кардиопротекции. У 16 пациентов из группы Креатинфосфат (20%) и 15 пациентов из группы Неотон (19%) после длительного периода асистолии восстановление ритма происходило через фибрилляции желудочков, проводилась электроимпульсная терапия.
Затем пациентам выполнялся хирургический гемостаз, ревизия зон анастомозов, ротация сердца, при этом у пяти пациентов из группы Креатинфосфат и шести пациентов из группы Неотон развилась фибрилляция желудочков и потребовалась дефибрилляция. В итоге, самостоятельное восстановление сердечной деятельности без электроимпульсной терапии после периода аноксии сердца и восстановления коронарного кровотока у пациентов сравниваемых групп выглядит следующим образом (табл. 2).
Таблица 2
Интраоперационное самостоятельное восстановление сердечной деятельности без электроимпульсной терапии
|
Параметр эффективности ЗМ |
Группа Креатинфосфат |
Группа Неотон |
|
Доля пациентов, у которых произошло самостоятельное восстановление СД |
0,73 (58 из 79) |
0,73 (58 из 79) |
|
95% ДИ |
(0,63 – 0,83) |
(0,63 – 0,83 |
Наиболее информативным критерием в оценке эффективности ЗМ, по мнению многих авторов [17,18,19], является интенсивность инотропной стимуляции миокарда в постреперфузионном периоде. В связи с исходно сниженной контрактильностью миокарда (ФВ<45%), в интра- и раннем послеоперационном периоде у 65% пациентов в группе Креатинфосфат и 58% пациентов в группе Неотон гемодинамика поддерживалась с помощью инотропных и вазопрессорных препаратов. По частоте применения, интенсивности, длительности и суммарной дозе инторопной и вазопрессорной поддержки различий между группами не выявлено ( табл.3, рис.2, рис.3).
Таблица 3
Применение инотропной/вазопрессорной поддержки в восстановительном периоде после кардиохирургического вмешательства
|
Параметр эффективности ЗМ |
Группа Креатинфосфат |
Группа Неотон |
р |
|
Доля пациентов, получавших инотропную/вазопрессорную поддержку |
0,65 (50 из 79) |
0,58 (47 из 79) |
0,417 |
|
95% ДИ |
(0,54 – 0,75) |
(0,47– 0,69) |
|
|
Количество инотропных/вазопрессорных препаратов на 1 пациента |
1,54 |
1,57 |
0,783 |
|
Ст. отклонение |
0,58 |
0,65 |
|
|
Суммарная доза добутамина на 1 пациента, мкг |
330908 |
398547 |
0,693 |
|
Ст. отклонение |
337476 |
437596 |
|
|
Доза норэпинефрина на 1 субъекта, мкг |
13541 |
13355 |
0,981 |
|
Ст. отклонение |
39261 |
30460 |
|
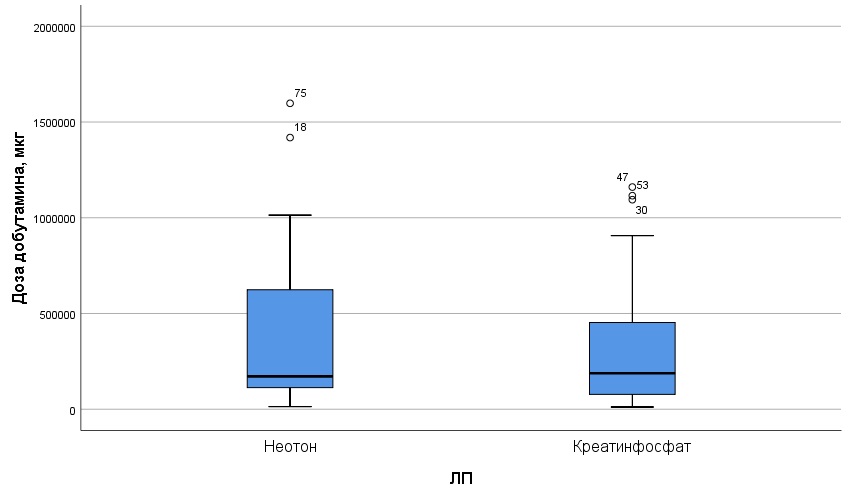
Рис.2. Суммарная доза добутамина в восстановительном периоде в сравниваемых группах
Рис.3. Суммарная доза норэпинефрина в восстановительном периоде в сравниваемых группах
Подводя итог анализа интенсивности инотропной и вазопрессорной стимуляции, как одного из критериев сохранности сократительной функции миокарда после тотальной ишемии, можно заключить, что применение кровяной защиты миокарда с экзогенным фосфокреатином в составе контролируемой реперфузии обеспечивает высокую жизнеспособность миокарда в послеоперационном периоде, несмотря на исходно сниженные функциональные резервы сердца.
Рефрактерная к медикаментозной терапии посткардиотомная сердечная недостаточность, потребовавшая механической поддержки кровообращения, развилась лишь у одного пациента из группы Неотон (1,27%), р=0,319.
По ЭхоКГ, проведенной у пациентов в ближайшем послеоперационном периоде (через 7±1 суток после операции), оценивалась фракция выброса левого желудочка. Данные сопоставлялись с дооперационной ЭхоКГ (табл. 4). Прирост ФВ левого желудочка более 10% расценивается многими авторами как критерий высокоэффективной интраоперационной защиты миокарда [19] .
Таблица 4
Фракция выброса левого желудочка через 7±1 суток после кардиохирургического вмешательства (по данным ЭхоКГ по сравнению с дооперационными)
|
Параметр эффективности ЗМ |
Группа Креатинфосфат |
Группа Неотон |
р |
|
Доля пациентов с приростом ФВ левого желудочка более 10% |
0,57 (45 из 79) |
0,47 (37 из 79) |
0,235 |
|
95% ДИ |
(0,46 – 0,68) |
(0,36– 0,59) |
|
Эффективность применения экзогенного ФК подтверждается уменьшением пиковых послеоперационных значений кардиоспецифических ферментов (TnT, TnI, CkMB). Нами проведено изучение динамики высвобождения биохимического маркера повреждения миокарда - высокочувствительного тропонина I (hsTnI) в крови из периферической вены (табл. 5).
Таблица 5
Значения высокочувствительного тропонина I (hsTn I) (среднее значение и стандартное отклонение) в периферической венозной крови по точкам наблюдения в группах сравнения, нг/мл
|
|
Точка наблюдения |
||||
|
|
1 (исходно) |
2 (2 часа п/о) |
3 (10-24 ч п/о) |
4 (34-48 ч п/о) |
5 (7±1 суток) |
|
Группа Неотон
|
167,2 (1077,4) |
10076,1 (17774,8) |
9304,8 (14537,6)
|
8259,2 (29366,6) |
3328,6 (22693,5) |
|
Группа Креатинфосфат
|
285,4 (1650,5) |
6971,4 (9462,6)
|
10054,6 (25652,5) |
7648,3 (28337,4) |
870,7 (2605,4) |
|
р |
0,593 |
0,172 |
0,821 |
0,894 |
0,342 |
Статистически значимые различия в динамике высвобождения биомаркера между группами сравнения отсутствовали. Интересно то, что в группе Креатинфосфат к седьмым суткам после операции значения высокочувствительного тропонина I возвратились к дооперационным показателям, что свидетельствует о выраженном кардиопротекторном действии экзогенного ФК (рис. 4).
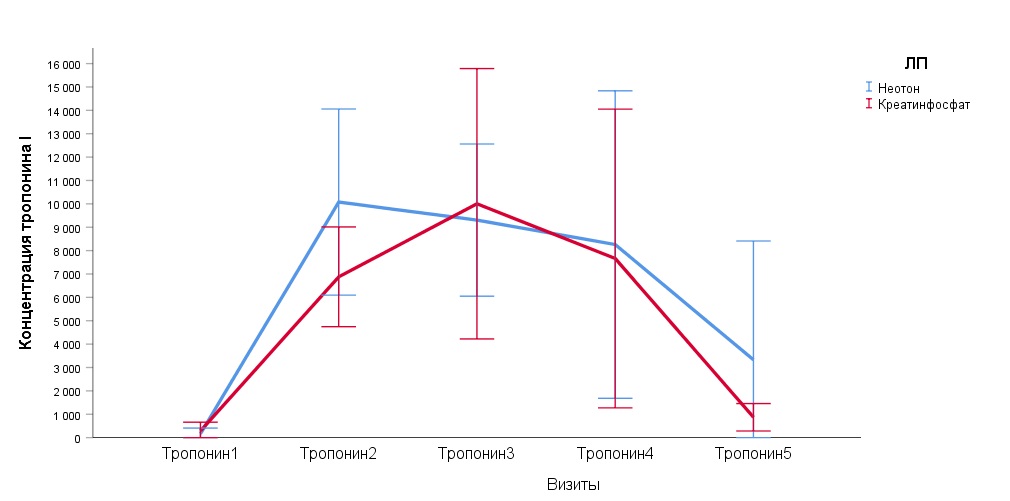
Рис.4. Динамика высокочувствительного тропонина I (hsTn I) (среднее значение и 95% ДИ) в периферической венозной крови пациентов по точкам наблюдения в группах сравнения, нг/мл
Была изучена ранняя (в течение 7 суток) выживаемость пациентов после операции. В группе Креатинфосфат она составила 98,7% (78 из 79 пациентов), в группе Неотон - 97,5% (77 из 79 пациентов), р=0,563. Статистически значимые отличия между группами отсутствуют.
Заключение
Накоплен значительный положительный опыт применения экзогенного фосфокреатина у кардиохирургических пациентов. Во время операций на открытом сердце в условиях искусственного кровообращения после периода глобальной ишемии миокарда введение препаратов экзогенного фосфокреатина в составе контролируемой тепловой реперфузии в концентрации 10 ммоль/л оказывает выраженное кардиопротекторное и антиаритмогенное действие. В дальнейшем это ассоциировано с высокими показателями ранней послеоперационной выживаемости и улучшением контрактильности миокарда в послеоперационном периоде. Особенно наглядно защитные макроэргические и мембраностабилизирующие эффекты экзогенного ФК проявляются у пациентов со сниженной фракцией выброса левого желудочка.
Достоверных различий по биохимическим показателям и клинической эффективности между группами с использованием лекарственного препарата Креатинфосфат и лекарственного препарата Неотон выявлено не было.
Литература
- Landoni G, Zangrillo A, Lomivorotov VV, Likhvantsev V, Ma J, De Simone F, et al. (2016) Cardiac protection with phosphocreatine: a meta-analysis. Interact Cardiovasc Thorac Surg. 23, pp 637–646.
- Mallet RT, Manukhina EB, Ruelas SS, Caffrey JL, Downey HF. (2018) Cardioprotection by intermittent hypoxia conditioning: evidence, mechanisms, and therapeutic potential. Am J Physiol Heart Circ Physiol. 315, pp 216–232.
- Ait-Aissa K, Blaszak SC, Beutner G, Tsaih SW, Morgan G, Santos JH, et al. (2019) Mitochondrial oxidative phosphorylation defect in the heart of subjects with coronary artery disease. Sci Rep. 9:7623.
- Lopaschuk GD, Ussher JR, Folmes CD, Jaswal JS, Stanley WC. (2010) Myocardial fatty acid metabolism in health and disease. Physiol Rev. 90 pp 207–258.
- Scolletta S, Biagioli B. (2010). Energetic myocardial metabolism and oxidative stress: let's make them our friends in the fight against heart failure. Biomed Pharmacother. 64, pp. 203–207.
- Hao Yi-Dan, Zhao Ying-Xin, Yang Shi-Wei, Zhou Yu-Jie (2021) High-Energy Phosphates and Ischemic Heart Disease: From Bench to Bedside . Front Cardiovasc Med. 2021; 8: 675608
- Perepech N.B., Nedoshivin A.O., Nesterova I.V. (2001). Neoton and thrombolytic therapy of myocardial infarction. Ter Arkh. 73, pp. 50–55.
- Saks V.A. (2014). Phosphocreatine pathway insidecellular energy transport: modern changing state of research. In book: Phosphocreatine: biochemical and pharmaceuticological effect and clinical change. / Ed. V. A. Saks, Yu. G. Bobkov, E. Strumia. M.: Nauka, 2014.
- Houang EM, Bartos J, Hackel BJ, Lodge TP, Yannopoulos D, Bates FS, et al. (2019). Cardiac muscle membrane stabilization in myocardial reperfusion injury. JACC Basic Transl Sci. 4, pp.275–287.
- Heather LC, Clarke K. (2011). Metabolism, hypoxia and the diabetic heart. J Mol Cell Cardiol. 50, pp. 598–605.
- Golikov AP, Riabinin VA. Neoton in the treatment of myocardial infarct and unstable stenocardia. Kardiologiia. (1993) 33, pp 3-15.
- Parratt J.R., Marshall R.J. (1974) The response of isolated cardiac muscle to acute anoxia: protective effect of adenosine triphosphate and creatine phosphate. J Pharm Pharmacol. 26, pp 427–433.
- Strumia E., Pelliccia F., D’Ambrosio G. (2012). Creatine phosphate: pharmacological and clinical perspectives. Adv. Ther., 29(2): pp 99–123.
- Cerný J, Nemec P, Bucek J, Cerný E, Papousek F, Lojek A. (1993) The effect of creatine phosphate in patients after surgery in ischemic heart disease. Vnitr Lek. 39, pp.153–159.
- Mingxing F, Landoni G, Zangrillo A, Monaco F, Lomivorotov VV, Hui C, et al. (2018) Phosphocreatine in cardiac surgery patients: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth. vol 32, pp.762–770.
- Cisowski M, Bochenek A, Kucewicz E, Wnuk-Wojnar AM, Morawski W, Skalski J, et al. (1996) The use of exogenous creatine phosphate for myocardial protection in patients undergoing coronary artery bypass surgery. J Cardiovasc Surg. 37, pp.75–80.
- Kozlov, I.A. Yavorovsky A.G. (2018). Creatine phosphate as cardioprotector in sugery and intensive cardiology. Analytical review Medical alfavit No 9 / 2018, vol 1. Urgent medicine
- Chambers DJ, Braimbridge MV, Kosker S, Yamada M, Jupp RA, Crowther A. (1991) Creatine phosphate (Neoton) as an additive to St. Thomas' Hospital cardioplegic solution (Plegisol). Results of a clinical study. Eur J Cardiothorac Surg 5, pp. 74–81.
- Zhidkov IL, Ivanov VA, Kozhevnikov VA, Charnaia MA, Mukhamedzianova AR, Trekova NA. (2007) Intraoperative myocardial protection with extracellular cardioplegic solutions in patients with cardiac valve diseases. Anesteziol Reanimatol. N 2, pp. 38–42.