Гилеп Ирина Леонидовна, доцент кафедры физиологии и биохимии, кандидат химических наук, доцент, БГУФК, РНПЦ спорта.
Гилеп Ирина Леонидовна, доцент кафедры физиологии и биохимии, кандидат химических наук, доцент, БГУФК, РНПЦ спорта.
Журнал «ПРИКЛАДНАЯ СПОРТИВНАЯ НАУКА» Международный научно-теоретический журнал № 2 (18).
УДК 796.1: 612.
СТР. 103-110.
Введение
Креатинфосфат впервые был выделен из мышечной ткани в 1927 году [1]. Однако изучение его роли и влияния на различные процессы в организме человека продолжается по настоящее время. Это объясняется тем, что креатинфосфат является энергетическим субстратом для быстрого синтеза АТФ в анаэробных условиях. То есть для образования АТФ не требуется кислород и участие митохондрий. В свою очередь АТФ является универсальным источником энергии в организме человека. Эта энергия необходима для синтеза веществ, мышечного сокращения, транспорта ионов [2, 3]. АТФ мало, около 4,5-5 ммоль/кг мышечной ткани. Поэтому в организме происходит постоянный его ресинтез [2]. Аэробный ресинтез осуществляется за чет окислительного фосфорилирования, анаэробный – гликолитическим процессом, креатинфосфокиназной реакцией. В основе креатинфосфокиназной реакции лежит синтез АТФ за счет гидролиза фосфамидной связи (N-P) креатинфосфата (CrP) [2].
Схематически эту реакцию можно записать в следующем виде:
MgADP + CrP2- + H+ MgATP2- + Cr (креатин)
Эта обратимая ферментативная реакция. Катализ осуществляет креатинкиназа (креатинфосфокиназа, КФК, CK) [4]. Еще в 1962 году было показано, что при ингибировании креатинкиназы в экспериментальных моделях уровень АТФ быстро снижался, что приводило к блокировке мышечного сокращения. [5].
В скелетных мышцах содержится около 90% креатинфосфата организма человека. При этом соотношение креатинфосфата к свободному креатину составляет ~67% к ~33% соответственно [6, 7]. Около 2% креатина в организме ежедневно теряется в результате неферментативного расщепления креатина до креатинина [8, 9].
Креатинфосфокиназная реакция обеспечивает быстрый синтеза АТФ в ситуациях с высокой метаболической потребностью. Например, при физических нагрузках высокой мощности и интенсивности [3].
Цель данной обзорной статьи – детально раскрыть механизм креатинфосфокиназной реакции, описать роль креатинфосфата в обмене веществ и энергии, и показать использование его при физических нагрузках, восстановлении и других клинических состояниях, основываясь на последних исследованиях.
Методы и организация исследования
Собраны и проанализированы результаты исследований, представленные в статьях зарубежных и отечественных авторов, касающиеся изучаемой темы. Данные о результатах исследований были систематизированы в соответствии с разделами обзорной статьи и позволили получить дополнительную интересную информацию о роли креатинфосфата.
Результаты исследования
Образование эндогенного креатинфосфата
По химической природе креатинфосфат является 2-[метил-(N'-фосфонокарбоимидоил)амино]уксусной кислотой. Синонимы – креатинфосфорная кислота, фосфокреатин. Схема строения представлена на рисунке 1 [2].
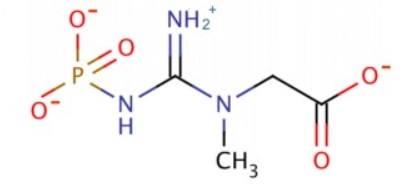
Рисунок 1 – Схема строения креатинфосфата.
Образуется креатинфосфат путем фосфорилирования креатина в клетках организма человека. Большая часть его находится в цитозоле в виде относительно мобильного пула метаболитов. Спектроскопия 1H и 31P MAS ЯМР демонстрирует полный гидролиз креатинфосфата до креатина и неорганического фосфата примерно через 2 часа после удаления мышечной ткани [10]. Креатин синтезируется в почках, печени и поджелудочной железе посредством двухэтапного процесса с участием трех аминокислот: аргинина, глицина и метионина [6, 11].
Креатинфосфатный челнок
Внутри клеток креатинфосфат выполняет функции челнока между местом производства и использования АТФ. В митохондриях путем окислительного фосфорилирования образуется АТФ, который не может транспортироваться через наружную митохондриальную мембрану [12]. Поэтому в межмембранном пространстве митохондрий АТФ фосфорилирует креатин с образованием креатинфосфата. Он транспортируется через митохондриальную мембрану в саркоплазму клеток. В саркоплазме при необходимости (например, при сокращении миофибрилл) креатинфосфат взаимодействует с АДФ и образуется АТФ и креатин. Креатин возвращается в митохондрии, где повторно фосфорилируется. [13]. Этот процесс получил название «креатинфосфатного челнока» (рисунок 2). Фермент «креатинфосфатного челнока» – креатинкиназа. Митохондриальные изоформы креатинкиназы катализируют образование креатинфосфата в митохондриях. А миофибрилярные изоформы данного фермента отщепляют фосфатную группу от креатинфосфата и переносят на АДФ с образованием креатина и АТФ [6].
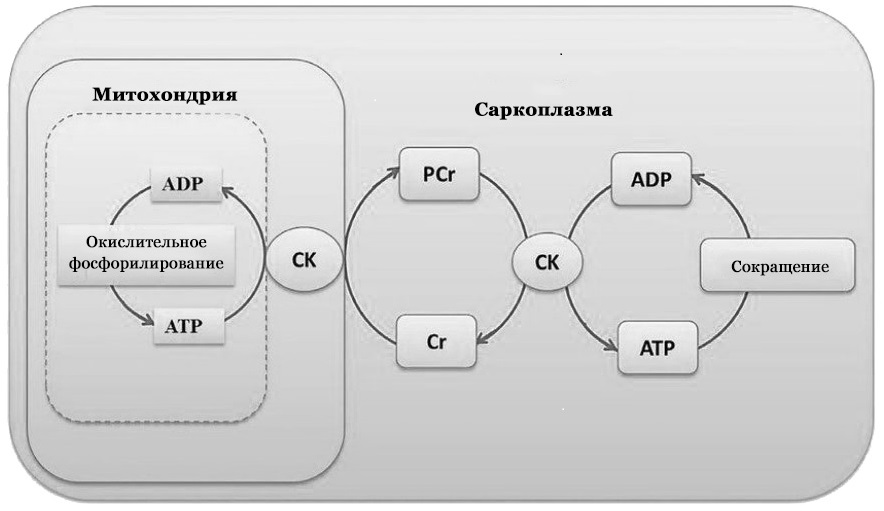
Рисунок 2 – Схема креатинфосфатного челнока.
Креатинкиназа
Фермент креатинкиназа обладает тканевой и клеточной специфичностью. Основу тканевой специфичности составляют наличие двух субъединиц, из которых состоит креатинкиназа: М (muscle-type) и В (brain-type). В мышечной ткани содержится креатинкиназа, состоящая из двух М субъединиц (MM-CK). В сердечной мышце преобладающей изоформой является гетеродимер креатинкиназы (МВ-СК). В головном мозге, почках, сперматозоидах, коже преобладает ВВ-СК изоформа. Описанная выше СК находится в цитоплазме клеток. Митохондриальная креатинкиназа расположена в межмембранном пространстве митохондрий и представлена в форме саркомерной mtCK (smtCK), экспрессируемой в основном в мышечной ткани, и универсальной mtCK (umtCK), экспрессируемой в большом количестве других клеток и тканей [14]. В головном мозге креатинкиназа наиболее интенсивно экспрессируется в областях с более высоким уровнем активности, таких как гиппокамп и мозжечок [15].
Основные функции в организме
- Основная функция креатинфосфата – энергетическая. Уже на 0,5-0,7 с интенсивной физической работы креатинфосфокиназный процесс достигает своей максимальной мощности – 3,8 кДж/кг/мин [3, 16] и на протяжении 15-30 с играет решающую роль в энергообеспечении кратковременной работы предельной интенсивности [3]. Например, бег на 100 м, прыжки, метания, упражнения в тяжелой атлетике. Креатинфосфат быстро ресинтезируется при снижении мощности работы или в период отдыха после нагрузки, когда преобладает аэробный ресинтез АТФ. Он может полностью восстановиться за 60–120 с [16, 17]. Повторное использование креатинфосфокиназного процесса может быть ограничено высокой концентрацией лактата и низкими значениями рН среды, как ингибитора СК [3, 16, 18, 19]. Например, на финише легче ускориться задействовав мощность креатинфосфокиназного процесса при беге на длинные дистанциии, чем на короткие.
При этом было показано, что креатинкиназа специфически связана с гликолитическими ферментами, которые либо участвуют в образовании АТФ, например пируваткиназа (ПК) [20], либо регулируют гликолиз, например, фосфофруктокиназа [21]. Таким образом, АТФ, которая образуется в гликолизе, может восстанавливать креатин до креатинфосфата. Это препятствует истощению креатинфосфата в анаэробных условиях и ингибированию фосфофруктокиназы (PFK), которая снижает активность при высокой концентрации АТФ. Так было показано, что мышцы пациентов с дефицитом PFK демонстрируют резкое замедление восстановления креатинфосфта после физической нагрузки [22].
- Креатинфосфат является энергетическим субстратом миокарда. Большое количество исследований сердечной недостаточности показывают истощение CrP при ишемии, аноксии, токсических кардиомиопатиях [1, 13, 24], при этом соотношение креатинфосфат/АТФ в миокарде уменьшается [23]. Также было показано, что соотношение креатинфосфат/АТФ в миокарде является значимым независимым предиктором смертности от сердечно-сосудистых заболеваний (5% при отношении CrP/АТФ >1,6; 10% при соотношении CrP/АТФ <1,6) в многофакторном анализе пациентов с сердечной недостаточностью [24].
- CrP взаимодействует с мембранными фосфолипидами. Его противоположные заряды взаимодействуют с заряженными фосфолипидами, расположенными по обе стороны от сарколеммы [1]. Это приводит к защите и стабилизации мембраны, влияя на дополнительные мембранные процессы, такие как ионный гомеостаз и клеточная передача сигналов. Стабилизация клеточных мембран в свою очередь препятствует лизису клеток [25, 26]. Креатинфосфат и креатинкиназа стабилизируют проницаемость митохондриальных мембран [14]. Более того, показан антиоксидантный механизм действия креатинфосфата, подтвердив, что он действует на липидный бислой, организуя мембранные фосфолипиды в структуре мембраны [27]. Мембраностабилизирующий эффект креатинфосфата лежит в основе его способности защищать сердце от ишемических повреждений, окислительного стресса. Свободные кислородные радикалы считаются основными причинами повреждения миокарда, особенно при ишемии и реперфузии [1, 23].
- Креатинфосфат стабилизирует аденилаткиназную (миокиназную) реакцию. В спортивной биохимии ее расматривают, как аварийный механизм, обеспечивающий ресинтез АТФ в условиях, когда другие пути ресинтеза АТФ малоэффективны [3]. Аденилаткиназная реакция заключается в образовании АТФ и АМФ за счет двух АДФ.
АДФ + АДФ ↔ АТФ +АМФ
При этом АМФ легко дезаминируется с образованием инозиновой кислоты [2, 3]. Было показано, что креатинфосфат ингибирует ферменты катаболизма АМФ: АМФ-дезаминазу и 50-нуклеотидазу [26]. При ингибировании активности 50-нуклеотидазы адениновая структура сохраняется в виде АМФ, а поскольку аденилаткиназная реакция образования АДФ обратима, АДФ и АТФ все равно образуются. Креатинфосфат также сохраняет пул адениновых нуклеотидов, воздействуя на синтез de novo. Креатинфосфат устраняет ингибирование АДФ фосфорибозилпирофосфатсинтазы (PRPP), фермента, который катализирует образование фосфорибозилпирофосфата из рибозо-5-фосфата и АТФ, что приводит к ресинтезу адениновых нуклеотидов [26].
- Показано, что креатинфосфат и креатинкиназа являются основой для распределения энергии в фоторецепторах (зрение), важны для поддержания слуха [14], для нормальной работы кожных покровов [28], пролиферации и роста волос [29]. Креатинфосфат способствует термогенезу посредством стимуляции митохондриального оборота АТФ в бурой жировой ткани и связан с M2-поляризацией в макрофагах. Метаболизм креатинфосфата в белых адипоцитах нарушается в состоянии ожирения как у людей, так и у мышей. Это приводит к изменению уровней АТФ/АДФ, что, в свою очередь, ослабляет активность 5'АМФ-активируемой протеинкиназы (AMPK). Этот фермент (АМРК) активирует транскрипцию различных провоспалительных генов, включая хемокин CCL2. [30].
Экзогенный креатинфосфат
Креатинфосфат может быть получен экзогенно с пищей. Однако он легко расщепляется в желудочно-кишечном тракте [31] и в организм человека поступает в виде креатина. К продуктам богатым креатином можно отнести рыбу, красное мясо, морепродукты [11, 32]. Как пищевая добавка для восстановления запасов креатинфосфата чаще используют моногидрат креатина [33]. Креатинфосфат вводится внутривенно (капельно), как быстрая энергетическая поддержка при различных стрессовых состояниях, в том числе при интенсивной физической нагрузки [1]. Чжан и др. (2015) показали, что введение CrP снижало высвобождение определенных воспалительных маркеров, таких как сывороточная креатинкиназа (CK), миелопероксидаза (MPO) и лактатдегидрогеназа (LDH) [34].
У гребцов на байдарках и каноэ с поражением опорно-двигательного аппарата, которые получали креатинфосфат болюсно по 1 г. после тренировки в течение 21 дня, в регуляции сердечного ритма отмечалось увеличение тонуса парасимпатического отдела вегетативной нервной системы, что свидетельствовало о повышении уровня экономичности функциональных систем организма, снижении общего уровня напряжения в регуляторных механизмах адаптации [35].
Было исследовано влияние 28-дневного приема динатриевых солей креатинфосфата с экстрактом черники (PCDSB), креатина моногидрата и плацебо на показатели мышечной силы, мощности и выносливости. Во время контрольных посещений испытуемые выполняли тест на усталость Торстенссона и Карлссона, который состоял из 50 максимальных односторонних, концентрических, изокинетических разгибаний левой ноги при 180°. Показано, что 28-дневный прием PCDSB не повлиял на массу тела, однако привел к увеличению мышечной силы [36].
Многочисленные исследования применения креатиновых добавок свидетельствуют о повышении внутримышечного креатинфосфата, улучшении буферной емкости крови, усилении ресинтеза гликогена, уменьшение окислительного стресса и воспаления [37]. Таким образом, креатиновые добавки положительно влияют на силу, быстроту, выносливость. Ускоряют восстановление после нагрузок и улучшают биохимические показатели, связанные с состоянием утомления [37]. Однако считается, что креатиновые добавки способствуют задержке воды внутриклеточной и общей, что может приводить к увеличению массы тела [38].
Показано, что креатин может влиять на физическую работоспособность, увеличивая повторное поглощение кальция саркоплазматическим ретикулумом, тем самым усиливая цикличность миофибриллярных поперечных мостиков и развитие силы [39, 40]. Кроме того, креатинфосфат действует как внутриклеточный буфер, так как при его гидролизе расходуется ион водорода [6]. При выполнении ступенчатого велоэргометрического теста (увеличение на 30 Вт каждые 3 минуты) прирост лактата в крови в конце каждого этапа был ниже при употреблении креатина (4 раза в день по 5 г креатина + 15 г глюкозы) [41]. По мнению авторов, этот эффект обусловлен сочетанием снижения зависимости от анаэробного гликолиза (из-за большей зависимости от креатинфосфатной системы) и увеличения буферной емкости.
Кроме того, пловцы (n = 19), получавшие 10 г креатина в день (вместе с углеводами в течение 7 дней), улучшили свой результат последних 50 м во время заплыва на 400 м по сравнению с контрольной группой [42]. Кроме того, кратковременный прием креатина (6 г/день в течение 5 дней) повышал анаэробные показатели (спринтерские интервалы) на 18 % без ухудшения выносливости у триатлонистов и не влиял на потребление кислорода или уровень лактата в крови (оценивали после каждого интервала) [43].
Было показано, что добавки креатина в сочетании с физическими упражнениями улучшают мышечную деятельность у пожилых мужчин и женщин в постменопаузе [44, 45], а также повышают минеральную плотность костей у здоровых пожилых мужчин [46].
Но именно инфузионный креатинфосфат целесообразно использовать в качестве кардиопротектора для лечения и профилактики ишемических повреждений миокарда [47-49]. Исследования in vitro и in vivo на ишемизированном миокарде [1] показало, что концентрация экзогенного CrP 10 ммоль снижает накопление лизофосфатидилхолина и лизофосфатидилэтаноламина в клетках, тем самым стабилизируя клеточные мембраны миокарда и предотвращая аритмии. Креатинфосфат уменьшал некроз ткани миокарда и сохранял нормальный метаболический, энергетический баланс [1].
В настоящее время появляется все больше свидетельств того, что креатин может выступать в качестве антидепрессанта [50-52], так как нарушения в синтезе, хранении и использовании энергии мозга связаны с развитием и поддержанием депрессивных состояний.
Важно отметить, что креатинфосфат не включен в список запрещенных субстанций, не является допингом. В Республике Беларусь (РБ) зарегистрирован препарат Креатинфосфат (фосфокреатин, креатинфосфата динатриевая соль) 1 г – лиофилизат для приготовления раствора для инфузий (СП ООО «ФАРМЛЭНД», РБ), который широко используется у пациентов кардиохирургического профиля [53] и может быть использован, с учетом имеющихся клинических и экспериментальных данных, в спортивной медицине.
Выводы
Таким образом роль креатинфосфата в обмене веществ и энергии важна и многогранна. Он первым включается в энергопродукцию при физической нагрузке, поддерживает работу миокарда, защищает и стабилизирует клеточные мембраны. Данные литературы свидетельствуют о способности креатинфосфата предупреждать деструктивные воздействия физической нагрузки и стресса на мышечные волокна, корригировать ряд негативных последствий интенсивных тренировок у спортсменов и может рассматриваться в качестве помощи различного уровня как лекарственное средство, не обладающие свойствами допинга, в тренировочном процессе и реабилитации.
Список использованных источников
1. Gaddi, A. V. Creatine Phosphate Administration in Cell Energy Impairment Conditions: A Summary of Past and Present Research / A. V. Gaddi, P. Galuppo, J. Yang // Heart Lung Circ. – 2017. Vol. 26, № 10. – P. 1026-1035.
2. Нельсон, Д. Основы биохимии Ленинджера: в 3 т. Т. 2: Основы биохимии, Биоэнергетика и метаболизм / Д. Нельсон, М. Кокс ; пер. с англ. – 5-е изд., перераб. и доп. – М. : Лаборатория знаний, 2022. – 636 с.
3. Биохимия мышечной деятельности: учеб. для вузов физ. восп. и спорта / Н. И. Волков [и др.]. – Киев: Олимп. Лит., 2000. – 503 с.
4. Guimarães-Ferreira L. Role of the phosphocreatine system on energetic homeostasis in skeletal and cardiac muscles / L. Guimarães-Ferreira // Einstein (Sao Paulo). – 2014. – № 12(1). – Р. 126–131.
5. Cain, D.F. Breakdown of adenosine triphosphate during a single contraction of working muscle / D.F. Cain, R.E. Davies // Biochem Biophys Res Commun. – 1962. – № 8. Р. 361-366.
6. Wyss, M. Creatine and creatinine metabolism / M. Wyss, R. Kaddurah-Daouk // Physiol Rev. – 2021. – Vol. 80. – Р. 1107–1228. Mode of access: pubmed.ncbi.nlm.nih.gov/10893433/. – Дата доступа: 10.09.2023.
7. Variables influencing the effectiveness of creatine supplementation as a therapeutic intervention for sarcopenia / Candow D [et al.] // Front Nutr. – 2019. Mode of access: pubmed.ncbi.nlm.nih.gov/31448281/. – Дата доступа: 10.09.2023.
8. Ostojic, S.M., Perspective: creatine, a conditionally essential nutrient: building the case / S. M. Ostojic, S. C. Forbes // Adv Nutr. – 2022. – № 8. – Р. 1334–1337.
9. Metabolic basis of creatine in health and disease: a bioinformatics-assisted review. D. A. Bonilla [et al.] // Nutr. – 2021. Mode of access: mdpi.com/2072-6643/13/4/1238/htm. – Дата доступа: 10.09.2023.
10. Resolution of creatine and phosphocreatine 1H signals in isolated human skeletal muscle using HR-MAS 1H NMR. / J. H. Chen Magn Reson Med. – 2008. № 59(6). Р. 1221-1224.
11. Functions and effects of creatine in the central nervous system / Andres R.H. [et al.] // Brain Res. Bull. – 2008. – № 76 – Р. 329–343.
12. Bessman, S. P. The creatine-creatine phosphate energy shuttle / S. P. Bessman // Ann Rev Biochem. – 1985. – № 54. Р. 831–862.
13. Strumia, E. Creatine phosphate: pharmacological and clinical perspectives / E. Strumia, F. Pelliccia, G. D’Ambrosio // Adv Ther. – 2012. – № 29(2). – Р. 99–123.
14. Wallimann, T. The creatine kinase system and pleiotropic effects of creatine / T. Wallimann, M. Tokarska-Schlattner, U. Schlattner // Amino Acids. – 2011. – № 40 (5). – Р. 1271–1296.
15. ‘Hot spots’ of creatine kinase localization in brain: Cerebellum, hippocampus and choroid plexus / Kaldis P. [et al.] // Dev. Neurosci. 1996. – № 18. – Р. 542–554.
16. Hargreaves, M. Skeletal muscle energy metabolism during exercise / M. Hargreaves, L. L. Spriet // Nat Metab. 2020. – №. 2(9). – Р. 817-828.
17. The time course of phosphorylcreatine resynthesis during recovery of the quadriceps muscle in man / R. C. Harris [et al.] // Pflugers Arch. – 1976. – № 367. Р. 137–142.
18. Regulation of skeletal muscle glycogen phosphorylase and PDH during maximal intermittent exercise // M. L. Parolin [et al.] // Am. J. Physiol. 1999. – № 277. – Р. Е890–E900.
19. Human muscle metabolism during intermittent maximal exercise / Gaitanos, G. [et al.] // C. J. Appl. Physiol. – 1993. – № 75. – Р. 712–719.
20. Dillon, P. F. The theory of diazymes and functional coupling of pyruvate kinase and creatine kinase / P. F. Dillon, J. F. Clark // J Theor Biol. 1990. – № 143. – Р. 275–284.;
21. Coupling of creatine kinase to glycolytic enzymes at the sarcomeric I-band of skeletal muscle: a biochemical study in situ / T. Kraft [et al.] // J Muscle Res Cell Motil. – 2000. – № 21. – Р. 691–703.
22. Impaired aerobic glycolysis in muscle phosphofructokinase deficiency results in biphasic post-exercise phosphocreatine recovery in 31P magnetic resonance spectroscopy / T. Grehl [et al.] // Neuromuscul Disord. 1998. – № 8. – Р. 480–488.
23. Беловол, А.Н. Энергетический метаболизм миокарда при сердечной недостаточности и возможности медикаментозной коррекции / А. Н. Беловол, И. И. Князькова // Практiчна ангiологiя. 2012. − № 1/2. − С. 11–18.
24. Cardiac high-energy phosphate metabolism in patients with aortic valve disease assessed by 31P-magnetic resonance spectroscopy / Neubauer S. [et al.] // J Investig Med. – 1997. – № 45(8). – Р. 453–462.
25. Phosphocreatine Interacts with Phospholipids, Affects Membrane Properties and Exerts Membrane-Protective Effects / M. Tokarska-Schlattner [et al.] // PLoS One. – 2012. − № 7(8). Mode of access: ncbi.nlm.nih.gov/pmc/articles/PMC3422282. – Дата доступа: 10.09.2023.
26. Molecular cellular aspects of the cardio protective mechanism of phosphocreatine / V. A. Saks [et al.] // Biokhimiia. – 1992. № 57(12). – Р. 1763–1784.
27. Conorev, E. A. Improvement in contractile recovery of isolated rat heart after cadioplegic ischemic arrest with endogenous phosphocreatine: Involvement of antiperoxidative effect / E. A. Conorev, V. G. Sharov, V.A. Saks // Cardiovasc Res. – 1991. – № 25. – Р. 164–171.
28. Zemtsov, A. Skin phosphocreatine / А. Zemtsov // Skin Res Technol. – 2007. – № 13. – Р. 115–118.
29. Creatine kinase and creatine transporter in normal, wounded, and diseased skin / U. Schlattner [et al.] // J Invest Dermatol. – 2002. – № 118. – Р. 416–423.
30. Impaired phosphocreatine metabolism in white adipocytes promotes inflammation / S. Maqdasy [et al.] // Nat Metab. – 2022. – № 4(2). Р. 190-202. Mode of access: ncbi.nlm.nih.gov/pmc/articles/PMC8885409. – Дата доступа: 10.09.2023.
31. Clark, J. F. Creatine and phosphocreatine: a review of their use in exercise and sport / J. F. Clark // J Athl Train. – 1997. – № 32(1). – Р. 45-51.
32. Kreider, R. B. Bioavailability, efficacy, safety, and regulatory status of creatine and related compounds: a critical review / R. B. Kreider, R. Jäger, M. Purpura // Nutrients. – 2022. – № 14. Mode of access: pubmed.ncbi.nlm.nih.gov/35268011/. – Дата доступа: 10.09.2023.
33. Creatine and creatine forms intended for sports nutrition / S. Andres [et al.] // Nutr. Food Res. – 2017. – Vol. 61. – № 6. – Р. 1271-1296.
34. Zhang, W. Protective effects of phosphocreatine administered post- treatment combined with ischemic post-conditioning on rat hearts with myocardial ischemia/reperfusion injury / W. Zhang, H. Zhang, Y. Xing // J Clin Med Res – 2015. –№ 7(4) – Р. 242–247.
35. Лагутин, М. П. Влияние метаболического препарата неотон на регуляцию сердечного ритма у спортсменов с поражением опорно-двигательного аппарата - гребцов на байдарках и каноэ / М. П. Лагутин, Н. Б. Котелевская // Адаптивная физическая культура. – 2015. – № 4 (64). – С. 10-14.
36. The effects of phosphocreatine disodium salts plus blueberry extract supplementation on muscular strength, power, and endurance / J. P. V. Anders [et al.] // J Int Soc Sports Nutr. – 2021. – № 18(1). Mode of access: ncbi.nlm.nih.gov/pmc/articles/PMC8427883/.– Дата доступа: 10.09.2023.
37. Creatine supplementation and endurance performance: surges and sprints to win the race / S. C. Forbes [et al.] // J Int Soc Sports Nutr. – 2023. - № 20(1). Mode of access: ncbi.nlm.nih.gov/pmc/articles/PMC10132248/. – Дата доступа: 10.09.2023.
38. Branch, J. D. Effect of creatine supplementation on body composition and performance: a meta-analysis / J. D. Branch // Int J Sport Nutr Exerc MetabInt J Sport Nutr Exerc Metab. – 2003. – № 13. – Р. 198–226.
39. Common questions and misconceptions about creatine supplementation: what does the scientific evidence really show? / J. Antonio [et al.] // J Int Soc Sports Nutr J of the Int Soc of Sports Nutr. – 2021. – № 18. – Р. 1–17.
40. International society of sports nutrition position stand: safety and efficacy of creatine supplementation in exercise, sport, and medicine / Kreider RB. [et al.] // J Int Soc Sports Nutr J of the Int Soc of Sports Nutr. – 2017. Mode of access: ncbi.nlm.nih.gov/pmc/articles/PMC5469049/. – Дата доступа: 10.09.2023.
41. Oral creatine supplementation’s decrease of blood lactate during exhaustive, incremental cycling / J. M. Oliver [et al.] // Int J Sport Nutr Exerc MetabInt J Sport Nutr Exerc Metab. – 2013. – № 23. – Р. 252–258. Mode of access: pubmed.ncbi.nlm.nih.gov/23164647/. – Дата доступа: 10.09.2023.
42. Anomasiri, W. Low dose creatine supplementation enhances sprint phase of 400 meters swimming performance / W. Anomasiri, S. Sanguanrungsirkul, Р. Saichandee // J Med Assoc Thail. – 2004. – № 87. –Р. S228– S232.
43. Creatine supplementation in endurance sports / M. Engelhardt [et al.] // Med Sci Sport Exerc. – 1998. – № 30. – Р. 1123–1129.
44. Creatine supplementation improves muscular performance in older men. / L. A. Gotshalk [et al.] // Med Sci Sports Exerc. – 2002. – №. 34. – Р. 537–543.
45. Creatine supplementation stimulates collagen type I and osteoprotegerin secretion of healthy and osteopenic primary human osteoblast-like cells in vitro / I. Gerber [et al.] // Bone. – 2008. – № 42. –Р. S21.
46. Chilibeck PD, Chrusch MJ, Chad KE, Shawn Davison K, Burke DG. Creatine monohydrate and resistance training increase bone mineral content and density in older men. [et al.] // J Nutr Health Aging. – 2005. – № 9. – Р. 352–353.
47. Терещенко, С. Н. Эффективность неотона у больных с хронической сердечной недостаточностью в зависимости от фракции выброса левого желудочка. Субанализ исследования BYHEART. / С. Н. Терещенко, И. А. Черемисина, А. А. Сафиуллина // Российский кардиологический журнал. – 2022. – № 27(11). Mode of access: doi.org/10.15829/1560-4071-2022-5276. – Дата доступа: 10.09.2023.
48. Михин, В. П. Эффективность креатинфосфата в составе комплексной терапии у больных с хронической сердечной недостаточностью, перенесших инфаркт миокарда с подъемом сегмента ST / В. П. Михин, Т. А. Николенко, Н. И. Громнацкий // Лечебное дело. – 2020. – № 1. – С. 64-70.
49. Creatine deficiency and heart failure. / D. A. Franco [et al.] // Heart Fail Rev. – 2022. – № 27(5). – Р. 1605-1616.
50. Creatine for the Treatment of Depression / B. M. Kious [et al.] // Biomolecules. – 2019. – № 9. Mode of access: ncbi.nlm.nih.gov/pmc/articles/PMC6769464/. – Дата доступа: 10.09.2023.
51. Allen P.J. Creatine metabolism and psychiatric disorders: Does creatine supplementation have therapeutic value? Neurosci. Biobehav. Rev. 2012. – № 36. – Р. 1442–1462.
52. Pazini F.L., Cunha M.P., Rodrigues A.L.S. The possible beneficial effects of creatine for the management of depression. Prog. Neuro-Psychopharmacol. Biol. Psychiatry. 2019. – № 89. – Р. 193–206.
53. Кежун Л.В. Кардиометаболическая терапия при COVID-19 инфекции // Медицинские новости. – 2021. – № 9. – С. 30-34.